¿Cuáles son las diferencias entre las teorías ácido-base de Arrhenius, Brønsted-Lowry y Lewis?
Understand the Problem
La pregunta se centra en las teorías ácido-base, especificando las definiciones y ejemplos de ácidos y bases según las teorías de Arrhenius, Brønsted-Lowry y Lewis.
Answer
Arrhenius: H+/OH-; Brønsted-Lowry: protones; Lewis: pares de electrones.
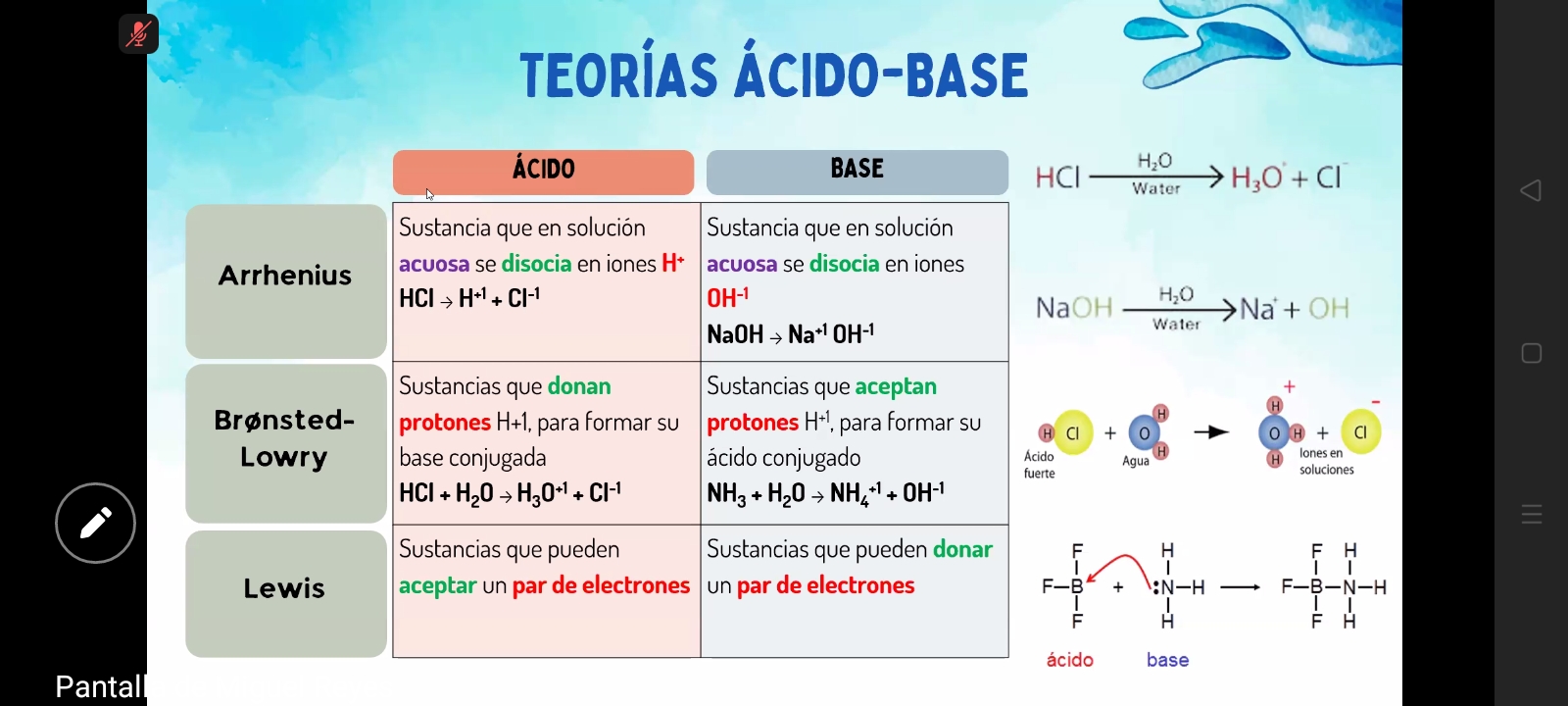
La teoría de Arrhenius se centra en ácidos que donan H+ y bases que donan OH- en soluciones acuosas. Brønsted-Lowry define ácidos como donantes de protones y bases como aceptores de protones, aplicable a más contextos. Lewis describe ácidos como aceptores de pares de electrones y bases como donantes de pares de electrones.
Answer for screen readers
La teoría de Arrhenius se centra en ácidos que donan H+ y bases que donan OH- en soluciones acuosas. Brønsted-Lowry define ácidos como donantes de protones y bases como aceptores de protones, aplicable a más contextos. Lewis describe ácidos como aceptores de pares de electrones y bases como donantes de pares de electrones.
More Information
Arrhenius es limitado a soluciones acuosas, Brønsted-Lowry es más universal para reacciones que involucran transferencia de protones, y la teoría de Lewis es más amplia aún, abarcando reacciones con pares de electrones.
Tips
Confundir las definiciones al aplicarlas en contextos erróneos, como usar Arrhenius fuera de soluciones acuosas.
Sources
- Teorías Ácido-Base: Arrhenius, Brønsted-Lowry y Lewis - Red Científica Escolar - redcientificaescolar.com
- Ácidos y Bases de Brønsted-Lowry - Khan Academy - es.khanacademy.org
- 7.2: Ácidos y Bases - LibreTexts Español - espanol.libretexts.org
AI-generated content may contain errors. Please verify critical information