Podcast
Questions and Answers
¿Quién propuso el modelo atómico que considera al átomo como un sistema planetario?
¿Quién propuso el modelo atómico que considera al átomo como un sistema planetario?
- Albert Einstein
- Niels Bohr
- John Dalton
- Ernest Rutherford (correct)
¿Qué característica introdujo Niels Bohr en su modelo atómico?
¿Qué característica introdujo Niels Bohr en su modelo atómico?
- La teoría de la relatividad
- La cuantización de la energía (correct)
- La idea de que los electrones orbitan el núcleo
- Laexistencia de protones y neutrones
¿Cuál es la características de las órbitas electrónicas en un átomo?
¿Cuál es la características de las órbitas electrónicas en un átomo?
- Son órbitas estacionarias y discretas (correct)
- Son órbitas irregulares
- Son órbitas elípticas
- Son órbitas circulares
¿Qué determina la identidad del elemento químico?
¿Qué determina la identidad del elemento químico?
¿Qué son isótopos?
¿Qué son isótopos?
¿Cuál es la función del número atómico?
¿Cuál es la función del número atómico?
¿Qué caracteriza el modelo de Rutherford?
¿Qué caracteriza el modelo de Rutherford?
¿Cuál es la configuración electrónica?
¿Cuál es la configuración electrónica?
¿Qué es el número másico?
¿Qué es el número másico?
¿Cuál es el nombre del modelo atómico que considera al átomo como una esfera indivisible?
¿Cuál es el nombre del modelo atómico que considera al átomo como una esfera indivisible?
Flashcards are hidden until you start studying
Study Notes
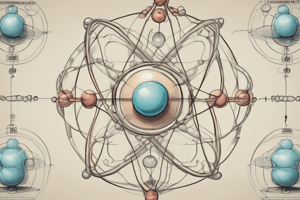
Modelo de Rutherford
- Propuesto por Ernest Rutherford en 1911
- Átomo como un sistema planetario:
- Núcleo central con carga positiva
- Electrones orbitando el núcleo
- Radio del núcleo mucho menor que el radio del átomo
- Experimento de Rutherford: dispersión de partículas alfa por una lámina de oro
- Conclusión: la mayoría de la masa del átomo se concentra en el núcleo
Modelo de Bohr
- Propuesto por Niels Bohr en 1913
- Modificación del modelo de Rutherford:
- Electrones en órbitas estacionarias y discretas
- Niveles de energía cuantizados
- Electrones saltan de una órbita a otra emitiendo o absorbiendo energía
- Introducción de la cuantización de la energía y la mecánica cuántica
Órbitas Electrónicas
- Trayectorias que siguen los electrones en un átomo
- Características:
- Orbital s (esférica): 1 electrón
- Orbital p (dumbbell): 3 electrones
- Orbital d (cuatro-leaf clover): 5 electrones
- Orbital f (compleja): 7 electrones
- Configuración electrónica: distribución de electrones en las órbitas
Número Atómico
- Número de protones en el núcleo del átomo
- Determina la identidad del elemento químico
- Simbolizado por Z
Isótopos
- Átomos del mismo elemento con diferente número de neutrones
- Misma configuración electrónica y propiedades químicas
- Diferente masa atómica y propiedades físicas
Número másico
- Suma del número de protones y neutrones en el núcleo del átomo
- Simbolizado por A
- Determina la masa del átomo
Modelo de Dalton
- Propuesto por John Dalton en 1803
- Átomo como una esfera indivisible y elemental
- Introducción de la teoría atómica moderna
Modelo Actual del Átomo
- Basado en la mecánica cuántica y la teoría de la relatividad
- Átomo como un sistema de partículas subatómicas:
- Protones y neutrones en el núcleo
- Electrones en órbitas estacionarias
- Interacciones entre partículas subatómicas
Partículas Subatómicas
- Componentes del átomo:
- Protones (carga positiva): en el núcleo
- Neutrones (carga neutra): en el núcleo
- Electrones (carga negativa): en órbitas
- Fotones (partículas de luz): intercambio de energía entre electrones
- Quarks (componentes de protones y neutrones): teoría de la cromodinámica cuántica
Modelo de Rutherford
- El modelo de Rutherford propone que el átomo es un sistema planetario con un núcleo central con carga positiva.
- Los electrones orbitan el núcleo y el radio del núcleo es mucho menor que el radio del átomo.
- El experimento de Rutherford demostró la dispersión de partículas alfa por una lámina de oro.
- La mayoría de la masa del átomo se concentra en el núcleo.
Modelo de Bohr
- El modelo de Bohr modificó el modelo de Rutherford introduciendo órbitas estacionarias y discretas para los electrones.
- Los electrones saltan de una órbita a otra emitiendo o absorbiendo energía.
- El modelo de Bohr introduce la cuantización de la energía y la mecánica cuántica.
Órbitas Electrónicas
- Las órbitas electrónicas son trayectorias que siguen los electrones en un átomo.
- Existen diferentes tipos de órbitas, como la orbital s (esférica), p (dumbbell), d (cuatro-leaf clover) y f (compleja).
- La configuración electrónica es la distribución de electrones en las órbitas.
Número Atómico y Número Másico
- El número atómico es el número de protones en el núcleo del átomo y determina la identidad del elemento químico.
- El número atómico se simboliza con Z.
- El número másico es la suma del número de protones y neutrones en el núcleo del átomo y se simboliza con A.
- El número másico determina la masa del átomo.
Isótopos
- Los isótopos son átomos del mismo elemento con diferente número de neutrones.
- Los isótopos tienen la misma configuración electrónica y propiedades químicas.
- Los isótopos tienen diferente masa atómica y propiedades físicas.
Modelo de Dalton y Modelo Actual del Átomo
- El modelo de Dalton propuso que el átomo es una esfera indivisible y elemental.
- El modelo actual del átomo se basa en la mecánica cuántica y la teoría de la relatividad.
- El modelo actual del átomo describe un sistema de partículas subatómicas, incluyendo protones, neutrones, electrones, fotones y quarks.
Partículas Subatómicas
- Las partículas subatómicas son componentes del átomo.
- Los protones tienen carga positiva y se encuentran en el núcleo.
- Los neutrones tienen carga neutra y se encuentran en el núcleo.
- Los electrones tienen carga negativa y se encuentran en órbitas.
- Los fotones son partículas de luz que se intercambian entre electrones.
- Los quarks son componentes de protones y neutrones, y se describen en la teoría de la cromodinámica cuántica.
Studying That Suits You
Use AI to generate personalized quizzes and flashcards to suit your learning preferences.