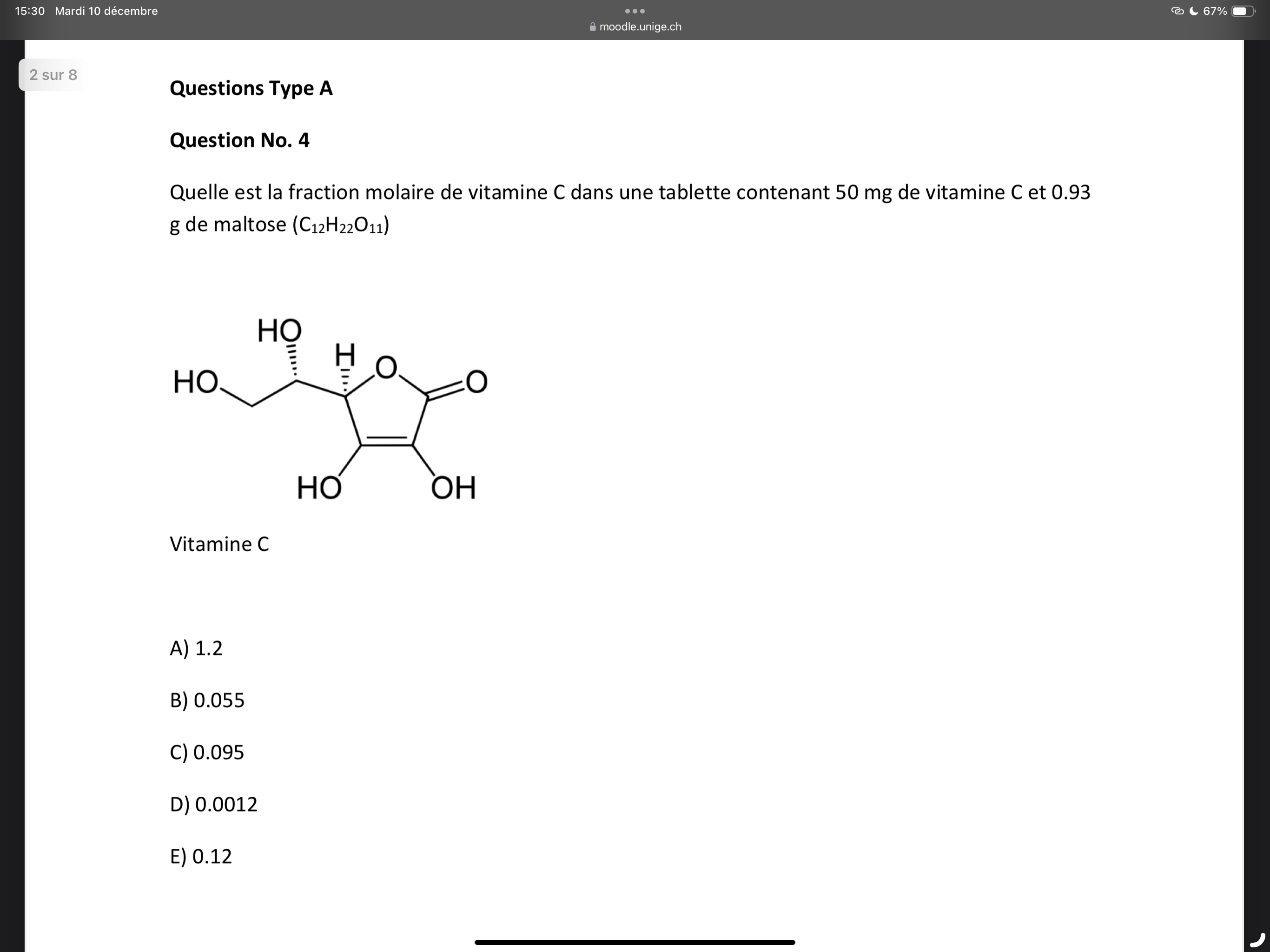
Quelle est la fraction molaire de vitamine C dans une tablette contenant 50 mg de vitamine C et 0,93 g de maltose ?
Understand the Problem
La question demande de calculer la fraction molaire de la vitamine C dans un comprimé contenant 50 mg de vitamine C et 0,93 g de maltose. Pour résoudre ce problème, il faut utiliser la formule de la fraction molaire qui est le rapport du nombre de moles d'un composant au total des moles dans le mélange.
Answer
La fraction molaire de la vitamine C est $0.095$.
Answer for screen readers
La fraction molaire de la vitamine C est d'environ $0.095$.
Steps to Solve
- Conversion des masses en moles pour la vitamine C
La masse de vitamine C est donnée en milligrammes (50 mg). Pour convertir cela en grammes, on utilise la conversion suivante : $$ 50 , \text{mg} = 0.050 , \text{g} $$
Ensuite, nous utilisons la formule pour le nombre de moles : $$ \text{moles} = \frac{\text{masse (g)}}{\text{masse molaire (g/mol)}} $$ La masse molaire de la vitamine C (C₆H₈O₆) est environ 176.12 g/mol. Donc : $$ \text{moles de vitamine C} = \frac{0.050 , \text{g}}{176.12 , \text{g/mol}} \approx 0.000284 , \text{mol} $$
- Conversion des masses en moles pour le maltose
Pour le maltose, nous avons 0.93 g. Sa masse molaire (C₁₂H₂₂O₁₁) est environ 342.30 g/mol. Alors, calculons le nombre de moles : $$ \text{moles de maltose} = \frac{0.93 , \text{g}}{342.30 , \text{g/mol}} \approx 0.002717 , \text{mol} $$
- Calcul des moles totales dans le mélange
Maintenant, additionnons les moles de vitamine C et de maltose pour obtenir le nombre total de moles : $$ \text{moles totales} = \text{moles de vitamine C} + \text{moles de maltose} $$ $$ \text{moles totales} = 0.000284 , \text{mol} + 0.002717 , \text{mol} \approx 0.003001 , \text{mol} $$
- Calcul de la fraction molaire de la vitamine C
La fraction molaire (X) de la vitamine C est calculée en divisant le nombre de moles de vitamine C par le total des moles : $$ X_{\text{vitamine C}} = \frac{\text{moles de vitamine C}}{\text{moles totales}} = \frac{0.000284 , \text{mol}}{0.003001 , \text{mol}} \approx 0.0945 $$
La fraction molaire de la vitamine C est d'environ $0.095$.
More Information
La fraction molaire est un concept important en chimie pour évaluer la proportion d'un composant dans un mélange. Dans ce cas, nous avons trouvé que vitamin C représente environ 9.45% des moles dans le comprimé.
Tips
- Oublier de convertir les milligrammes en grammes avant de calculer le nombre de moles.
- Ne pas additionner correctement les moles pour obtenir le total.
- Mal utiliser la masse molaire des composés.
AI-generated content may contain errors. Please verify critical information